1779-1848
Страна: Швеция
В мрачном коридоре университета в Упсале у кабинета про-фессора Йогана Афцелиуса переминались с ноги на ногу два тощих студента. Один из них нерешительно постучал в дверь, и сердце его замерло. Второй решительно нажал ручку двери, и вот уже оба стоят в кабинете, залитом солнцем, с множеством книжных шкафов по стенам. Профессор смотрел на них вопросительно.
— Мы пришли к вам с просьбой, — произнес один из студентов, — начну все по порядку.
Профессор снял очки, удобно устроился в кресле и приготовился слушать.
— Меня зовут Йене Якоб Берцелиус. А это мой брат Свен. Мы изучаем здесь медицину уже третий год.
— Братья, а совсем, не похожи друг на друга, — отметил вслух профессор.
— Свен — мой сводный брат, он моложе меня. Я родился в Вёферсунде. Это маленькая деревня на юге Швеции. Мой отец был директором школы, но я его не помню; он умер вскоре после моего рождения. Мать осталась без средств и вышла вторично замуж. Я был совсем маленьким, когда родился Свен. Но, помню, очень обрадовался, узнав, что у меня появился брат. Потом на нас обрушилось горе — мать заболела и через несколько месяцев умерла. Я остался круглым сиротой. Денег на жизнь не хватало, а отчим мало заботился обо мне. Школу я посещал ее регулярно, но учился хорошо. Когда вырос, уехал из дому в Упсалу. Я хотел изучить медицину и стать врачом. Моих сбережений хватило только на год. Я стал работать — помогал врачу в госпитале, давал частные уроки, и вот теперь я снова студент. Здесь, в университете, я понял, что, кроме медицины, есть много других интересных наук. Я тщательно изучил учебник Кристофа Гиртаннера «Основы антифлогистонной химии», а в библиотеке ознакомился с последними открытиями Алессандро Вольта. Химия привлекает меня все больше, и потому я пришел к вам. Разрешите нам с братом провести несколько химических исследований в вашей лаборатории.
Берцелиус ждал ответа. Неужели профессор откажет?
Профессор Афцелиус задумался. Он мысленно перенесся в свою юность, вспомнил студенческие годы, когда сам мечтал трудиться во имя науки... Профессор Афцелиус поднял голову и сказал:
— Я могу удовлетворить вашу просьбу. Для тех, кто любит химию, всегда найдется место в моей лаборатории. Передайте эту записку управляющему Нильсену, и все будет в порядке.
Он благосклонно смотрел на сияющие лица своих студентов. Поблагодарив профессора, братья тут же направились в лабораторию.
Йене мечтал начать опыты как можно скорее. Несколько лет назад, работая помощником врача в госпитале, он исследовал минеральные воды. Теперь он хотел еще раз проверить анализы и дополнить их. Исследование было очень подробным, и Берцелиус намеревался представить его в качестве докторской диссертации.
Молодой исследователь скоро закончил работу с минеральными водами и переключился на исследование окиси азота. В то время газы все еще были недостаточно изучены и привлекали внимание многих исследователей. Берцелиус и его брат провели подробные анализы, изучили свойства окиси азота. Полученные результаты Берцелиус привел в статье, которую послали в Стокгольм, но в своем ответе Шведская Академия наук сообщала:
«Применяемая вами антифлогистонная номенклатура неприемлема для нашего журнала, и потому мы не можем опубликовать вашу статью».
— Заниматься газами больше не будем, — решительно сказал Берцелиус брату. — Лучше начнем изучать действие электрического тока. Может быть, именно электричеству принадлежит будущее, а мы знаем о нем так мало, особенно о его действии на организм.
— Конечно, это тоже очень интересно. А что будет источником электричества? — спросил Свен.
— Построим батарею.
— Идея-то отличная, но как ее осуществить?
— Ничего, осуществим! Знаешь, Свен, нам нужно только достать медные и цинковые пластины, остальное найдем здесь, в лаборатории.
— Медные пластины. — Свен задумался. — Откуда их взять?
— Вот. У меня уже есть.
Берцелиус протянул руку. На его ладони лежала большая медная монета.
— Замечательно! — воскликнул Свен. — А цинк? Материал для цинковых пластин они нашли у собора. Тут
уже целый год работали мастера, обновляя его купол. Свен и Йене собрали целую кучу обрезков толстой цинковой жести, нарезали их на небольшие куски и стали собирать батарею, состоящую из 60 стаканов, в каждый из которых погрузили медную монету и цинковую пластину.
Затем братья приступили к исследованиям. Ток оказывал парализующее действие на животных — лягушек, мышей, а через несколько минут животные погибали. Берцелиус исследовал их внутренние органы. Накапливались очень интересные данные, но вскоре опыты пришлось приостановить. В 1802 году Берцелиус получил звание доктора медицины за исследование минеральных вод и через некоторое время уехал в Стокгольм. Его назначили ассистентом при Хирургической школе, но без выплаты жалованья.
Директор школы, доктор Бьернсен, встретил Берцелиуса со свойственной ему сдержанностью.
— У вас, как у врача, здесь много обязанностей. Надеюсь, вы будете исполнительны. У вас есть какие-нибудь средства на жизнь?
— Никаких. Студентом я жил на частные уроки.
— Теперь тоже следует найти учеников. Хочу верить, что через несколько лет вы сумеете доказать, что служите добросовестно, п тогда получите назначение с жалованьем.
Доктор Бьернсен помолчал с минуту, а затем спросил:
— Комнаты у вас наверняка тоже нет? Берцелиус кивнул.
— Позаботимся и об этом. Устрою вас в доме господина Вильгельма Хизингера. Он человек состоятельный и почтенный, владеет шахтами на севере Швеции. Дом у него большой, да и работы там хоть отбавляй. Платить за комнату вам не придется, но вы будете помогать ему в работе.
Хизингер (1766—1852) был своеобразным человеком. Шах-ты приносили ему большой доход, и он мог бы безбедно жить, но беспокойная натура его заставляла непрестанно искать в открывать новое. Большую часть времени он проводил в своей собственной лаборатории. Не получив систематического университетского образования, но обладая живым пытливым умом, Хизингер занялся анализом разнообразных минералов, собранных его помощниками. Многие из этих минералов еще даже не были названы, но Хизингер не сомневался, что в них содержатся неизвестные элементы. Он мечтал открыть какое-нибудь новое вещество, чтобы это открытие принесло ему славу. Знакомстве с Берцелиусом оказалось для него настоящей находкой. Теперь они совместно проводили химические исследования.
Лаборатория Вильгельма Хизингера находилась на нижнем этаже дома. Она была не очень большой по размерам, но зато в ней было все самое необходимое. Берцелиус стал проводить исследования, однако результаты не удовлетворяли его.
— Надо попробовать разложить вещества электрическим током. Некоторые ученые в этом добились хороших резуль-татов.
Хизингер готов был на руках носить своего нового столь способного помощника и с воодушевлением выполнял все его указания. Они добыли материалы для батареи, и через некоторое время в лаборатории появился источник электрического тока.
Коллеги приготовии водные растворы солей и стали пропускать через них электрический ток. Первые же результаты оказались чрезвычайно интересными: на отрицательном полюсе выделялся металл (медь, серебро, никель) или пузырьки водорода, на положительном полюсе — кислород. Берцелиус исследовал растворы около полюсов и установил, что после прохождения тока раствор у положительного полюса приобретает кислый характер, а у отрицательного — щелочной.
— Если после протекания электрического тока соли разлагаются, образуя кислоту и основание, приходится принять, что все соли состоят из кислоты и основания. Последние притягиваются отрицательным полюсом. Это означает, что они заряжены положительно, — утверждал Берцелиус.
— Тогда кислоты должны быть отрицательно заряженными, не так ли? — спросил его Хизингер.
— Конечно. Все опыты дают нам одни и те же результаты. Металлы тоже должны быть положительными, как и основания, которые они образуют, потому что они тоже выделяются на отрицательном полюсе.
— Помнишь, Йене, несколько дней назад ты рассказал мне об исследованиях англичанина Гемфри Дэви. Он установил, что основание содержит кислород. Но ведь, по мнению Лавуазье, кислоты содержат кислород?
— Они оба правы, Вильгельм. Основания получаются при соединении металла с кислородом, а кислоты — при соединении неметалла с кислородом.
Эти первоначальные наблюдения легли в основу известной дуалистической электрохимической теории. Молодой Берцелиус работал над ней в течение последующих лет, и она стала впоследствии отправной точкой в трудах ученых первой четверти XIX века.
Результаты этих исследований Берцелиус и Хизингер описали в статье, которая осталась почти не замеченной учеными.
Внимание обоих исследователей привлек интересный минерал. Они разлагали его концентрированной серной кислотой и попытались получить с помощью электрического тока содержащийся в нем металл. Однако это им не удалось: вместо металла на отрицательном полюсе образовалось бесцветное, с едва заметным желтым оттенком порошкообразное вещество, нерастворимое в воде. Назвали его цериевой землей, или церием.
— Несомненно, это окись какого-нибудь неизвестного металла, но, к сожалению, он очень прочно связан с кислородом. Даже электричество не может их разъединить.
— Все-таки это важное открытие, — сказал Хизингер. — И пусть кто-то другой получит чистый металл, окисел которого открыли мы.
Независимо от них в Германии Мартин Клапрот тоже получил эту окись, но и он не смог выделить чистый металл.
Предвидение Хизингера сбылось. Спустя почти три десятилетия Карлу Густаву Мосандеру удалось выделить чистый металл — церий.
Берцелиус всегда работал углубленно и точно. Его считали одним из самых образованных людей в Швеции. В мае 1806 года он был назначен лектором химии в Хирургическую школу. Таким образом отпала забота о заработке. Кроме работы в лаборатории, он начал писать учебник по физиологической химии. Просматривая литературу в библиотеке, он наткнулся на книгу
Иеремии Рихтера «Основные начала стехиометрии или искусство измерять элементы». В этой книге Рихтер говорил о «соединительных весах». Рассматривая реакции между кислотами и основаниями, он делал важный вывод: «Если определенное количество кислоты нейтрализуется различными основаниями, то количества оснований эквивалентны между собой и могут нейтрализоваться одним и тем же количеством другой кислоты». Эти количества Рихтер назвал соединительными весами.
Несколько дней спустя Берцелиус прочитал знаменитые статьи Джона Дальтона об атомной теории и о первых попытках определить атомный вес элементов.
Берцелиус нашел идеи Дальтона многообещающими и стал ревностным приверженцем атомной теории. Но его критический склад ума и тонкая интуиция искусного аналитика подсказали ему, что данных, приведенных во многих статьях, недостаточно. Надо было синтезировать все возможные соединения какого-либо элемента, с большой точностью проанализировать их, вычислить соединительные веса, и только тогда можно было установить истинную величину атомного веса. Это была весьма нелегкая задача, труд, непосильный одному человеку. И все-таки Берцелиус занялся установлением атомных весов. Он понимал, что для достижения цели требовалось много труда и времени, но это не могло остановить его. Он решил атаковать элементы один за другим и определить их атомные веса.
Берцелиус начал с самого простого вещества — воды. Тщательно проведенные анализы позволили установить ее процентный состав: 11% водорода и 89% кислорода.
— Если за основу возьмем атом водорода, то получится, что одной весовой части водорода соответствуют 8 весовых частей кислорода, а не 7, как определил Дальтон. Можно ли быть наверняка уверенным, что один атом водорода соединяется с одним атомом кислорода? Это только предположение. Если атом водорода вступает во взаимодействие с двумя атомами кислорода, атомный вес последнего должен быть равен 4. В противном случае, когда два водородных атома связываются с одним атомом кислорода, атомный вес кислорода будет равен 16. Как видим, возможно несколько сочетаний, следовательно, приходится искать способ установления истины.
Берцелиус не находил покоя: как выйти из этого заколдованного круга?
В 1807 году его назначили профессором Стокгольмского университета, а через год Берцелиус был уже членом Академии наук. Еще два года спустя ему было поручено руководство кафедрой химии и фармации Каролинского медико-хирургического института. Но по-прежнему для него существовала только одна, занимавшая все его мысли проблема — атомные веса.
Сравнивая результаты исследований многих ученых, Берцелиус пришел к выводу, что вода состоит из двух атомов водорода у одного атома кислорода. В таком случае атомный вес кислорода должен быть равен 16. Анализы шли хорошо, но трудность появилась в другом. Водород образовывал очень мало соединений с элементами, а с большинством вообще не соединялся. Надо было бы выбрать другой, более активный элемент, думал ученый.
Для Берцелиуса, как и для Лавуазье, кислород имел исключительное значение в химии. Он образовывал окислы со всеми. известными элементами. Кроме того, было известно и о других соединениях, которые также содержали кислород. Это давало-возможность непосредственно определять атомные веса элементов по отношению к кислороду. Берцелиус твердо верил, что работа сильно упростится, если атомные веса определять па кислороду.
— Если атомный вес — условная величина, кратная основной единице, для сравнения удобнее выбрать кислород и принять его атомный вес за 100. Тогда элементы легче кислорода будут иметь атомные веса меньше 100, а более тяжелые — больше 100.
Однако самая важная проблема оставалась пока не решенной. Для каждого отдельного случая приходилось устанавливать формулу соединения, то есть определять число связанных между собой атомов, чтобы можно было вычислить атомный вес, изучать свойства веществ, сравнивать их, искать новые методы анализа.
Берцелиус был неутомимым. Число синтезированных, очищенных и проанализированных веществ нарастало с каждым месяцем — 100, 200, 300... Минули годы. Веществ стало 1000, а Берцелиус все еще продолжал работать — упорно и систематически. На протяжении почти 20 лет он изучил более 2000" соединений известных тогда 43 элементов, чтобы определить их атомные веса. Успех его был бесспорным, большая часть полученных значений определена с той же точностью, с какой и ныне вычислены атомные веса элементов.
Долгим и трудным был путь, по которому Берцелиус шел к истине. Например, он принимал, что одному атому металла.
чтобы образовать окисел, нужно было связаться по крайней мере с одним атомом кислорода. На основании этого допущения он предложил следующие формулы окислов меди: CuО (для красного) и CuO2 (для черного). Такое же предположение он сделал и в отношении двух окислов ртути: HgO и HgO2. Поскольку окислы многих металлов были сходны по своим свойствам с черным окислом меди, Берцелиус написал их формулы следующим образом: СаО2, MgO2, ZnO2, FeO2 и так далее. Высший окисел железа содержал в полтора раза больше кислорода, поэтому его формула должна быть FеО3. Окислы хрома и алюминия, свойства которых были аналогичны свойствам высшего окисла железа, Берцелиус обозначал формулами СrОз и АlO3. Такие ошибочные представления о формулах этих окислов изменились только тогда, когда Берцелиус узнал, что хром образует еще один окисел, который взаимодействует с водой, давая хромовую кислоту. В соответствии с более высоким содержанием кислорода формулу этого окисла надо написать как СrО6. Берцелиус изучил свойства хромовой кислоты и установил, что она сходна с серной кислотой. Но ангидридом серной кислоты является SO3, тогда и ангидрид хромовой кислоты — СrО3. В таком случае низший окисел хрома следовало обозначить формулой Сr2О3, а аналогичные по свойствам окислы железа и алюминия— формулами Fe2Оз и Аl2O3. Применение этих формул требовало изменения формул и низших окислов: ZnO, CaO, FeO, MgO и так далее.
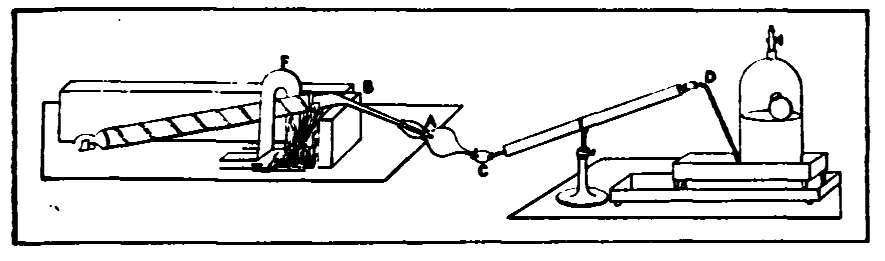
Аппаратура Берцелиуса для сожжения органических веществ
Взаимодействие элементов объясняется тем, что противоположные заряды притягиваются. Например, самый отрицательный элемент — кислород — притягивается остальными элементами и соединяется с ними. Образовавшиеся окислы, однако, не являются нейтральными; у них тоже есть электрический заряд. Окислы металлов заряжены положительным электричеством, а неметаллов — отрицательным. Между ними также действует сила притяжения, и при их взаимодействии образуются соли. Окись кальция, например, положительна, а двуокись углерода отрицательна. При их взаимодействии образуется карбонат кальция.
Полученные в результате реакций соли тоже не абсолютно нейтральны: они несут некоторый положительный или отрицательный заряд. Две противоположно заряженные соли могут притягивать друг друга и образовывать двойную соль. Квасцы, например, получаются из положительного сульфата натрия и отрицательного сульфата алюминия.
Теория была простой, наглядно объясняла все химические процессы, и поэтому она сразу же снискала всеобщее признание. Ее называли дуалистической, так как в ее основу было положено существование двух противоположных начал — положительного и отрицательного электричества.
Берцелиуса ценили как ученого не только в Швеции, но и в Западной Европе. Он поддерживал переписку с видными деятелями науки Германии, Англии, Франции... Особенно долго он переписывался с Клодом Луи Бертолле и Гемфри Дэви. Он мечтал о встрече с этими великими учеными, хотел ближе познакомиться с их исследовательской деятельностью, обсудить некоторые проблемы.
В 1812 году Берцелиус получил разрешение выехать во Францию, но война между Францией и Россией помешала ему осуществить свои планы. И он отправился в Англию.
Берцелиус с нетерпением ждал встречи с Дэви. Но тот, однако, оказал ему холодный прием. Дэви незадолго до этого женился и готовился к свадебному путешествию по Европе. Берцелиус был поражен такой встречей и считал, что хлопоты, связанные с отъездом, никак не могли оправдать Дэви. Он предполагал, что причина такого отношения к нему английского ученого кроется в другом.
Дэви достиг вершин славы путем упорного труда и самообразования. Однако ему не хватало глубоких теоретических знаний. Он понимал тем не менее, что электрохимическая теория Берцелиуса была достаточно убедительной. Дэви чувствовал, что у шведского ученого глубокий и проницательный ум, хорошая теоретическая подготовка, и немало этому завидовал.
Берцелиус встретился в Лондоне с другим ученым — Александром Марситом, с которым связали его впоследствии узы дружбы.
— Я хотел бы, доктор, Марсит, посетить ваши лекции по химии, посмотреть, как вы демонстрируете опыты, как объясняете теоретические проблемы. Одним словом, хочу поучиться у вас, — обратился к нему Берцелиус.
— Едва ли вы чему-либо можете научиться у меня, господин Берцелиус, но я в вашем полном распоряжении. Надеюсь, нам обоим пойдет на пользу наше знакомство.
Доктор Марсит помог Берцелиусу в разработке лекций по химии и практических занятий с демонстрацией опытов. Берцелиус встречался в его доме с Уильямом Уолластоном, Смитсо-ном Теннантом, Фредериком Акумом, Томасом Юнгом, Джемсом Уаттом, Уильямом Гершелем и другими учеными. Он подробно осмотрел их лаборатории, интересовался новой аппаратурой и приборами, заказал в Лондоне все, чего не хватало в его собственной лаборатории в Стокгольме.
В Швецию Берцелпус вернулся в конце октября 1812 года и привез три огромных ящика с оборудованием. Лаборатория оказалась слишком тесной, чтобы разместить все необходимое, и поэтому часть приборов пришлось вывезти в подвалы Каролинского медико-хирургического института.
Он с новой энергией принялся за работу и опять — за свое любимое дело: определение атомных весов. Берцелиус провел анализы большого числа соединений и вычислил атомные веса почти всех элементов. Он приступил уже к составлению таблиц, но что-то его постоянно смущало, и он чувствовал какую-то неудовлетворенность. Берцелиус чертнл разнообразные кружки, которыми Дальтон обозначал элементы, и недовольно кривил губы.
— До чего же неудобны эти знаки! Их трудно писать, они сложны для запоминания, а когда приходит время их печатать, возникает целая трагедия.
У печатников действительно не было таких знаков, их приходилось готовить специально. Каждый печатник отливал знаки различной величины, и формулы получались очень пестрыми. Необходимо было изобрести новый, более удобный способ обозначения элементов.
Берцелиус взял список элементов и принялся внимательно его рассматривать, мысленно перечисляя основные свойства каждого из элементов.
Самое удобное—обозначить элементы буквами. Тогда не будет необходимости в специальных типографских знаках. И, кроме того, они легче запоминаются и пишутся. Допустим, достаточно первой буквы латинского названия элемента. Кислород в таком случае будет обозначаться буквой О (оксигениум), а водород Н (гидрогениум). Берцелиус с увлечением начал записывать названия и знаки элементов, пока не дошел до ртути. Ее латинское название начинается тоже с Н (гидраргирум). Что ж, значит, к первой букве нужно добавить еще один знак. Латинские названия углерода, хрома и меди тоже начинаются с одной и той же буквы — С. Следовательно, выбор букв должен подчиняться какой-то закономерности. Во избежание повторений он предложил одной буквой обозначать неметаллы, а если возникает необходимость, добавлять вторую букву, которая должна применяться для металлов. Для обозначения углерода осталась буква С, для меди — Сu, а для хрома — Сr. Согласно этому правилу, он обозначил азот буквой N, никель — Ni, водород — Н, ртуть — Hg и так далее.
Статья Берцелиуса о новой номенклатуре была опубликована в 1813 году в журнале Томсона «Философские летописи». Год спустя в том же журнале Берцелиус опубликовал вторую статью, в которой сформулировал правила написания формул. Число атомов он обозначал цифрой, поставленной в верхнем конце знака. Если соединение содержало два атома данного элемента, он предлагал писать знак жирной буквой, а в формулах окислов обозначал атом кислорода точкой или запятой. Так, для воды вместо H2О он писал Н•, а для окиси серы — S вместо SO3. Новые обозначения химических элементов были довольно скоро приняты учеными: они оказались очень удобными, но вот формулы стали применять лишь в середине XIX века. Только Джон Дальтон и Томас Томсон остались до конца своей жизни противниками новых знаков и продолжали обозначать элементы различными кружками.
Весной 1813 года к Берцелиусу приехал из Англии Уильям Мак-Майкл.
— Мне поручили передать вам свои наилучшие пожелания доктор Марсит, Уильям Уолластон и Джемс Уатт.
— Расскажите, как чувствует себя доктор Марсит? Как его исследования? — поинтересовался Берцелиус.
— Я учился у доктора Марсита, а к вам приехал по его настоянию изучать химию.
— Но ведь я сам был у него в прошлом году и изучал химию!
— Возможно, но доктор Марсит да и остальные английские химики считают вас одним из крупнейших представителей современной химической науки. Они убеждены, что именно у вас можно многому научиться.
Многие молодые исследователи мечтали работать в лаборатории Берцелиуса. Широта его познаний и интуиция, с которой он оценивал опытные данные, привлекали ученых, и многие начали свой путь в науку в лаборатории Берцелиуса.
Мак-Майкл стал работать у Берцелиуса, изучая методы количественного анализа. Никто другой не владел этим искусством лучше шведского химика. Берцелиус усовершенствовал старые методы и создал новые. Он никогда не скрывал своих достижений и с радостью передавал свои знания молодым. Он писал учебники, готовил критические обозрения опубликованных в Европе научпых статей. И все это с единственной целью — облегчить работу исследователей. С 1820 года до конца своей жизни Берцелиус по поручению Академии наук издавал «Ежегодные обзоры». Этот журнал стал ценным справочником, все его номера переводились на немецкий язык и выходили в свет в Берлине, а последние 8 годовых комплектов были переведены на французский язык.
— Наука — огромный океан. Чтобы плавать в нем, надо быть опытным рулевым, надо иметь путеводную звезду, — не раз повторял ученый.
— Изучит ли когда-нибудь человечество полностью этот океан? — спросил его как-то Мак-Майкл.
— Быть может, через сто лет или еще больше в науке будут работать тысячи людей. Тогда они изучат не только поверхность океана, но и его глубины, тоща...
Берцелиус не закончил. В кабинет вошла женщина в траурном платье. Удивленный, ученый поднялся ей навстречу.
— Госпожа Экеберг! Что привело вас в Стокгольм?
— Приехала искать помощи, господин Берцелиус.
— Мак-Майкл, познакомьтесь: вдова недавно скончавшегося профессора Андерса Экеберга из Упсалы, — сказал Берцелиус и, обратившись к госпоже Экеберг, продолжил: — а это господин Уильям Мак-Майкл из Лондона. — Она вежливо поклонилась.
— У нас денежные затруднения, господин Берцелиус. Пришлось продать даже кое-какие вещи за долги. Вам известно, конечно, о большой коллекции минералов мужа. Не откажите в любезности направить меня в какой-нибудь институт, который купил бы ее.
— Извините, что я вмешиваюсь в вашу беседу. Однако мне кажется, что коллекцией может заинтересоваться Британский музей, — сказал Мак-Майкл.
Вскоре Мак-Майкл получил полномочия купить у госпожи Экеберг коллекцию ее мужа. Минералы, приведенные в порядок и заботливо упакованные, прибыли в Стокгольм в нескольких десятках ящиков. Мак-Майкл пересмотрел их и решил отобрать только самые редкие и красивые экземпляры, остальные передал Берцелиусу.
— Минералы будут прекрасным пособием при демонстрациях опытов на лекциях химии, — сказал Мак-Майкл, объясняя причину столь щедрого подарка.
Берцелиус занялся приведением в порядок коллекции с особенным усердием и интересом. В то время уже существовали классификации, предложенные Ренэ Жюстом Гаюи, Гаусманом и другими учеными-минералогами. Согласно этим классификациям, очень часто два совершенно различных по химическому составу элемента ставили рядом, а близкие по составу минералы относили к различным группам. Естественно, требовалась новая, более совершенная классификация.
Берцелиус начал изучать минералы. Наряду с минералогическим исследованием он проводил и полный количественный анализ. С самого начала он установил, что большая часть минералов содержит «кремневое вещество» (кремнезем). Связываясь с другими окислами металлов, это вещество образует соединения, которые входят в состав минералов. «Кремневое вещество» играет огромную роль при минералообразовании. Содержащие его минералы Берцелиус назвал силикатами («силекс» по-латыни — «кремень»). Берцелиус установил, что соотношение остальных окислов металлов с «кремневым веществом» в силикатах различное — 1:1, 1:2, 1:3... В соответствии с этим он разделил силикаты на три большие группы. Для удобства он рассматривал каждый минерал как бы составленным из определенного числа окислов, связанных между собой в соответствующих пропорциях. Этот способ выражения состава минералов используют и ныне в минералогии и петрографии.
Свои результаты исследований минералов он опубликовал в 1814 году в статье, где впервые предлагал новую, чисто химическую классификацию минералов. Работа вызвала огромный интерес, и ее сразу перевели на английский и немецкий языки.
В том же году он опубликовал и первую таблицу атомных весов, которая явилась результатом его восьмилетней исследовательской работы.
Берцелиус продолжал заниматься минералогией и в дальнейшем. Побудил его вернуться к этому владелец шахт в Фалуне Юхан Готтлиб Ган, который зашел как-то к Берцелиусу по делу.
Ган лет сорок назад впервые выделил металл, который ныне называют марганцем. У него была собственная лаборатория, в которой он проводил химические исследования минералов.
Ган говорил размеренно, прислушиваясь к каждому произнесенному им слову:
— Вот уже год как я работаю с кварцевой жилой, но она остается для меня загадкой. Не поддается да и только.
— Чем же она так интересна? — спросил Берцелиус.
— Я убежден, что она содержит незнакомый минерал, а быть может, и новый элемент. Но, видимо, годы берут свое, и я уже не могу работать один, да и методы мои, судя по результатам, несовершенны. Эта задача только вам по силам, Берцелиус. Займитесь анализами.
— Ну что ж, давайте вместе изучать кварцевую жилу, господин Ган.
Через несколько дней они выехали в Фалун, где находилась великолепно оборудованная лаборатория Гана. Ган проводил анализ вещества в пламени паяльной трубки. Это была маленькая стеклянная трубка, изогнутая с одного конца под прямым углом. Этот конец Ган вносил в пламя спиртовой лампы и равномерно дул в другой конец. Воздушная струя отклоняла пламя и направляла его на кусочек древесного угля. В маленькое углубление в угле Ган помещал смесь порошкообразного минерала, соды и селитры. Под действием высокой температуры, а также соды и угля происходили изменения, по которым можно было судить о составе минералов.
Это был так называемый сухой анализ. Берцелиус усвоил этот удобный и незамысловатый способ работы. Параллельно с исследованиями, которые имели целью определить содержащиеся в жиле элементы, они начали анализ мокрым способом. Самые большие затруднения вызвало «кремневое вещество». Чтобы отделить его от остальной части пробы, им пришлось долго обрабатывать ее концентрированной соляной кислотой, отфильтровывать нерастворимый остаток, повторяя эту операцию несколько раз.
Недели упорной и напряженной работы — и одна за другой были определены составные части кварцевой жилы. Оставалось неразгаданным лишь одно вещество, по свойствам не похожее нп на одно соединение из известных тогда элементов. Это был белый порошок, который с водой соединялся, как негашеная известь, то есть с выделением тепла. Но окисью кальция это соединение не было, так как полученное студнеобразное вещество не растворялось в воде. На воздухе оно медленно высыхало, превращаясь в твердую, подобную фарфору, массу.
— В воде не растворяется, но, смешиваясь с ней, придает среде отчетливо выраженную щелочную реакцию, — отметил Берцелиус.
— Следовательно, мы имеем дело с основным окислом, — заметил Ган.
— Да, но это окисел незнакомого нам металла. Свойства его предположительно близки к свойствам кальция и алюминия, однако все это требует проверки.
С помощью паяльной трубки и угля им не удалось получить зерна металла.
— А может, нагревания недостаточно? Попробуем применить другой способ.
Исследователи неоднократно изменяли условия опытов, пытаясь выделить кислород из окисла и получить чистый металл, но безуспешно.
— Этот металл непобедим подобно богу-громовержцу Тору. — Берцелиус засмеялся. — Назовем его торием.
Но то, что открыли оба исследователя, не было торием. Тринадцатью годами позже, в 1828 году, Фридрих Вёлер успешно восстановил этот окисел и назвал полученный металл иттрием. И в том же году Берцелиус открыл в норвежском минерале, присланном в его лабораторию для анализа, другой новый элемент, который и назвал торием.
Закончив работу в Фалуне, Берцелиус приступил к составлению учебника по химии, который был опубликован в 1816 году в трех томах. Почти одновременно печатались и его переводы на французский и немецкий языки. Еще при жизни Берцелиуса только в Швеции учебник выдержал пять изданий. Это был самый полный, самый систематизированный и самый популярный учебник химии, по которому в течение более трех десятилетни обучались сотни молодых химиков.
Несмотря на разницу в возрасте, Ган и Берцелиус стала большими друзьями. Старый ученый часто заходил в лабораторию своего молодого коллеги и любовался мастерством, с которым Берцелиус проводил опыты.
— Восхищаюсь тобой, Йене. Я всегда мечтал иметь такого сына. Ох, какой силищей мы были бы вместе, но...
— Милый, добрый Ган, ты сделал для науки все, что было в твоих силах. И за это мир благодарен тебе.
— Человек никогда не бывает доволен собой. Всегда хочется сделать больше, чем ты смог. Вот и сейчас — нет мне покоя. Андерсон, обанкротившись, решил продать свою фабрику. Если бы у меня был такой сын, как ты, я, не раздумывая, купил бы ее. На ней производят самые различные химикаты: серную кислоту, уксус, белый свинец и многое другое.
— Я ничего не слышал о случившемся. Но как же все-таки разорился Андерсон? Ведь фабрика работала бесперебойно и давала доход.
— Послушай, Йене. Купим фабрику вместе? Я буду вести дело, а ты консультировать.
Берцелиус задумался. А может, действительно стоит купить фабрику? Это принесет ему дополнительные доходы, необходимые для его научной деятельности.
Новые владельцы быстро привели расстроенные дела в порядок, и работа наладилась. Берцелиус посещал фабрику редко, но Гаи бывал там неотлучно.
Цех по производству серной кислоты работал нормально, однако в двуокиси серы содержались какие-то примеси, потому что в камерах накапливался красно-бурый илистый осадок, который время от времени приходилось выбрасывать. Сваленный в кучу, этот осадок постепенно высыхал, превращаясь в рыхлую, похожую на глину массу. Берцелиус взял маленький комочек осадка, чтобы исследовать его в лаборатории с помощью паяльной трубки на угле. Как только вещество нагрелось, над углем стали появляться маленькие голубоватые язычки пламени, а потом потянулся вверх белый дымок. По всей лаборатории распространился неприятный запах.
— Неужели это сера? Вещество горит, подобно сере, но откуда белый дым? Ведь двуокись серы — газ бесцветный.
Берцелиус взял большую пробу и возобновил исследование. При кипячении с азотной кислотой вещество полностью растворялось, а после длительного отстаивания из раствора выкристаллизовывались великолепные белые игольчатые кристаллы.
От Берцелиуса не ускользнули и самые, казалось бы, незначительные подробности. Он установил, что эти бесцветные кристаллы являются окислом, весьма похожим на двуокись серы, так как с водой они образовывали кислоту, подобную сернистой. Исследователь сумел получить в свободном состоянии и элемент — красно-бурый порошок, горевший голубоватым пламенем, подобно сере. Стоит подумать над названием для нового элемента, решил Берцелиус. Он вспомнил, как лет десять назад немец Мартин Клапрот назвал открытый в Трансильвании элемент «теллур», в честь планеты Земля («теллус» по-гречески— «земля»). Свойства теллура похожи на свойства серы.
— Назову-ка я новый элемент в честь Луны — селениум.
Так в 1817 году был открыт селен. Берцелиус занялся определением его атомного веса и продолжил работу по определению атомных весов других элементов. Новые проблемы возникали одна за другой, и Берцелиусу уже трудно было справляться одному. Необходимость в помощнике стала очевидной. И Берцелиус нашел его. Это была Анна Бланк — молодая голубоглазая белокурая женщина. Она не только помогала ему по хозяйству, но была интересным собеседником и умела скрасить ученому часы одиночества после трудной, напряженной работы в лаборатории. Но самым большим достоинством Берцелиус считал ее влечение к науке. Она стала настоящим помощником ученому в его исследованиях.
— Вы переписали новую таблицу атомных весов, Анна? Дайте мне просмотреть еще раз.
— Рукопись тоже готова. Ее можно отсылать?
Это была вторая таблица атомных весов. В это время забота о химической фабрике целиком легла на плечи Берцелиуса, так как его старый друг Юхан Ган скончался.
В 1818 году Берцелиуса избрали секретарем Академии наук. Это была большая честь, которая ко многому и обязывала. Прошло еще несколько лет, и Берцелиуса торжественно посвятили в рыцарский сан. Почести и слава теперь повсюду сопровождали ученого. Однако от напряженной работы и от постоянного соприкосновения с вредными химикатами его стали одолевать головные боли.
Врачи рекомендовали Берцелиусу уехать лечиться на юг, п он последовал их совету. По пути он посетил Англию, где встретился со своими старыми добрыми знакомыми, а потом поехал во Францию. В Аркёйе, имении Бертолле, ему оказали поистине королевский прием.
В большом зале в Аркёйе собрались самые выдающиеся французские ученые. Здесь были Доминик Франсуа Араго, Жан Батист Био, Пьер Луи Дюлонг, Мишель Эжен Шеврель, Жорж Кювье, Пьер Симон Лаплас, Луи Жак Тенар, Жозеф Луи Гей-Люссак, Луи Никола Воклен, Андре Мари Ампер, а также немецкий естествоиспытатель Александр Гумбольдт.
Берцелиус выступил с обстоятельным докладом. Особый интерес вызвала у собравшихся электрохимическая теория. К его немалому удивлению во Франции о ней почти ничего не знали. Это побудило Берцелиуса немедленно подготовить новую рукопись на французском языке и опубликовать ее во время своего пребывания в Париже.
Химическая классификация элементов явилась предметом его беседы с Гаюи. Несколько дней Берцелиус с восхищением осматривал огромную минералогическую коллекцию ученого. Здесь были собраны многие из самых красивых, самых совершенных творений природы. В знак дружбы Гаюи подарил Берцелиусу несколько великолепных друз.
Повсюду в Париже Берцелиус был желанным гостем. Он посетил лекции Гаюи, Воклена, Тенара, Гей-Люссака, Био и Броньяра. Особенно понравился ему Гей-Люссак. Французский химик излагал самые сложные вопросы так просто, что слушать его было истинным удовольствием; немало способствовала этому, быть может, и превосходная дикция ученого. Слушая его лекции, Берцелиус извлек для себя большую пользу. Даже достигнув самых высоких вершин в науке, он никогда ые переставал учиться и совершенствовать свои знания. Он общался с широким кругом ученых, изучал труды по самым разнообразным проблемам, всегда пытаясь найти для себя что-то новое, еще не познанное. Его стремление к знаниям было поистине безграничным.
За работой Берцелиуса по определению атомных весов элементов с большим интересом следили многие ученые. Некоторые из них тоже проводили подобные исследования, иные пытались открыть закономерности, которые связывают атомный вес со свойствами элементов. Особенно интересными оказались исследования двух французских ученых — Пьера Луи Дюлонга и Алексиса Тереза Пти, которые определили количество тепла, необходимого для повышения температуры одного грамма вещества на один градус, и атомную теплоемкость элементов (количество тепла, необходимое для повышения температуры 1 грамм-атома вещества на один градус). Первые же исследования принесли желаемые результаты: атомная теплоемкость всех элементов оказалась одной и той же и равнялась приблизительно шести. Рукопись с описанием этих исследований должна была быть опубликована в журнале Парижской Академии наук. Берцелиус ознакомился с ней в кабинете Дюлонга.
— Ваше открытие может быть использовано и для определения атомных весов, — сказал Берцелиус.
— Каким образом? — удивился Пти.
— Обычно число атомов данного элемента, которые входят в состав соединения, не может быть определено непосредственно. Тогда мы ищем аналоги, обращаемся к косвенным методам, а часто используем и совершенно произвольные допущения. Теперь на основе вашего открытия мы сможем выбрать правильное число значительно легче и увереннее.
— А ведь и верно. Нужно только умножить удельную теплоемкость элемента на его атомный вес. Произведение должно дать цифру, близкую к шести, — подхватил мысль Берцелиуса Дюлонг.
— Я горю желанием тут же приступить к вычислениям, дорогой Дюлонг, но не для всех элементов известна удельная теплоемкость.
Дюлонг горько улыбнулся. Восемь лет назад при исследовании им хлорида азота произошел взрыв, в результате которого ученый лишился зрения и двух пальцев правой руки. Какое-то мгновение... но оно отняло у него самое дорогое, смысл всей жизни: работать во имя науки. Теперь он постоянно нуждался в помощниках. Но и слепой, Дюлонг продолжал упорно экспериментировать. Вопрос об атомных весах являлся краеугольным камнем, и поэтому Берцелиус и Дюлонг приступили к совместной работе. Берцелиус проводил эксперименты, а потом вместе с Дюлонгом обсуждали полученные результаты. Исследователи уточнили атомные веса водорода, азота и кислорода, определили плотности кислорода, азота и двуокиси углерода.
Перемена климата благотворно сказалась на здоровье Берцелиуса, и он решил поехать во Фрейберг. Он хотел познакомиться с работой Академии горного дела и металлургии.
Во время своей поездки во Францию он побывал в некоторых геологических районах, имеющих немаловажное значение для экономического развития страны. И повсюду он завязывал знакомства, приобретая новых друзей.
В Швейцарии Берцелиус вновь встретился с доктором Мар-ситом и познакомился с Теодором де Соссюром. В Тюбингене у него состоялась встреча с Христианом Гмедином21, который когда-то был его учеником. Наконец, посетив Берлин, Берцелиус вернулся на родину.
Теперь ему предстояло начать новую проверку атомных весов. Закон Дюлонга и Пти и закон изоморфизма Эйльгарда Митчерлиха открыли ему новые возможности. Свои исследования Берцелиус проводил совместно с Митчерлихом и Генрихом
Розе — двумя молодыми немецкими учеными, приехавшими в Стокгольм для усовершенствования своих знаний и ознакомления с современными методами научной работы.
Это был период расцвета творческой деятельности Берцелиуса, пожалуй, самого крупного ученого первой половины XIX столетия. Его деятельность на протяжении последующих десяти лет сопровождалась частыми поездками в Европу. Однако работу в лаборатории он не оставлял. За это время он получил в свободном состоянии и изучил кремний, титан, цирконий и торий. Занимаясь классификацией минералов, Берцелиус установил, что «кремневое вещество» является окислом неизвестного элемента, соединения которого знал еще Карл Вильгельм Шееле. «Кремневое вещество» знакомо ученым с давних времен, но, к сожалению, никто не мог получить этот элемент в свободном состоянии.
Имея в виду исключительную активность калия, Берцелиус решил проверить, не отнимет ли этот металл фтор от фторида кремния. Он получил соединение по методу Шееле и подверг его действию металлического калия. Его предположения оправдались. По окончании реакции в сосуде остался коричневый порошок, который легко сгорал и превращался в «кремневое вещество». Это был новый элемент, который получил название «силициум» (кремний).
Метод оказался весьма удобным, и Берцелиус решил применить его к соединениям других элементов, еще не выделенных в свободном состоянии. И действительно добился успеха. В 1824 году при обработке двойной соли фторида калия — циркония металлическим калием был впервые получен цирконий. На следующий год таким же методом он получил титан. Много затруднений доставил ученому неизвестный элемент, который содержался в минерале, присланном ему из Норвегии. Берцелиус извлек этот элемент из горной породы с помощью фторида калия и подверг восстановлению металлическим калием. Процесс протекал легко, но новый металл обладал высокой активностью и почти мгновенно превращался в окисел. Приняв специальные меры для предохранения его от окисления, Берцелиус сумел получить новый металл, правда в весьма незначительном количестве. Этот элемент получил название «торий». Еще тринадцать лет назад, когда Берцелиус работал вместе с Ганом, он предложил то же самое название для элемента, окисел которого они тогда изолировали из минерала, полученного в шахтах Фалуна. Исследования Вёлера показали, что открытый ими окисел принадлежал элементу пттрию. Теперь, однако, сомнений не было: открытый Берцелиусом элемент — торий. Элемент получался в незначительных количествах, и это обстоятельство мешало изучению его свойств. Тогда Берцелиус решил подробно исследовать свойства окиси тория.
В этот период в лаборатории Берцелиуса работали п совершенствовали свои познания в химии многие псследователи, ставшие впоследствии известными учеными. Среди них были Фридрих Вёлер, Герман Гесс, Густав Магнус, Карл Густав Мо-сандер и другие.
В 1826 году Берцелиус полностью завершил работу по определению атомных весов элементов и опубликовал третью по счету таблицу атомных весов. Почтп все значения в ней были точными, за исключением атомных весов серебра, калия и натрия; Берцелиус принимал, что формула их окислов МеО, а не Ме2O, каковой она является в действительности.

Параллельно с лабораторными исследованиями Берцелиус занимался и научно-литературной деятельностью. Он систематически читал все публикации в области химии и готовил короткие резюме-доклады о каждой статье. Эти резюме печатались в известном тогда реферативном журнале «Яресберихте» — «Ежегодные обзоры».

Огюст Лоран
В 1832 году вместе с англичанином Уильямом Джонстоном, ставшим впоследствии профессором химии в Дархеме, Берцелиус исследовал соединения олова. Вот уже несколько раз они получали довольно странные результаты. Анализы окислов олова показывали, что по химическому составу должен быть только один высший окисел. В лаборатории, однако, исследователи получали два различных вещества.
— В чем же разгадка тайны? Ясно, что одному химическому составу отвечает только одно соединение, однако здесь опыт показывает обратное, — рассуждал Берцелиус.
— Может быть, это своего рода исключение? — заметил Джонстон.
— Исключения тоже надо уметь объяснить.
И все-таки Берцелиус нашел объяснение этому загадочному явлению. Оказалось, что и другие ученые столкнулись с подобными фактами. Вёлеру, например, удалось превратить цианат аммония в мочевипу. Оба вещества обладали совершенно одинаковым количественным составом, но их свойства коренным образом разнились. И открытый Фарадеем газ бутилен представлял ту же загадку. Бутилен состоит из 85,7% углерода и 14,3% водорода. Этим же количественным составом обладает и «олефиновый газ» (этплеп), по его удельный вес вдвое меньше, чем у бутилена. Берцелиус все больше убеждался в том, что существуют несколько веществ с одинаковым количественным составом, но различными свойствами. Это явление он называл изомерией. Позднее ученые установили существование многих видов изомерии, а когда ввели понятие «молекулярный вес» и получила развитие органическая химия, такое родство, как у бутилена с этиленом, стали называть гомологией.
В 1841 году Берцелиус предложил термин «аллотропия» для установленной им способности одного и того же элемента существовать в виде различных простых веществ. В то время уже были открыты и изучены аллотропные формы углерода, серы, фосфора.
Порой жизнь приносила Берцелиусу и разочарования, и, в частности, они были связаны с развитием органической химии. В это время ученые открыли и изучили реакции, которые не только не могли быть объяснены с помощью электрохимической теории, но, наоборот, полностью противоречили ей. Ученые открыли также новые реакции, при которых водород замещался хлором. Согласно теории Берцелиуса, это было невозможно, поскольку хлор отрицателен, а водород положителен. Но электрохимическая теория утверждала, что положительно заряженный водород связывается в соединения с отрицательно заряженным элементом, следовательно, хлор не может замещать его:. в результате реакции соединились бы два отрицательных элемента.

Жан Батист Дюма
Они должны были отталкиваться, а не соединяться! Однако хлорирование органических соединений было фактом, хотя и противоречило теории Берцелиуса. Исследователи получали все новые и новые соединения и изучали их свойства.
Вопреки очевидности Берцелиус сомневался в подлинности получаемых учеными данных. Он обвинял авторов статей в фальсификации и не мог поверить, что монохлоруксусная кислота получается при замещении одного атома водорода уксусной кислоты хлором. Он подверг уничтожающей критике теорию ядер Огюста Лорана, согласно которой органические соединения образуются из одного основного углеводорода. Как считал Лоран, соединение органических веществ подчиняется закону, аналогичному закону Гей-Люссака о простых объемных отношениях: органические вещества связываются между собой в простых объемных отношениях.
Несмотря на все усилия Берцелиуса защитить электрохимическую теорию, дальнейшее развитие химии требовало новых, более совершенных идей.
Жан Батист Дюма полностью опроверг теорию Берцелиуса. Времена менялись, накапливались новые факты, появлялись новые ученые. Наука неуклонно развивалась.
Работы нового поколения химиков невольно приносили все больше и больше огорчений великому ученому. Он чувствовал себя от этого еще более одиноким и только теперь всерьез стал подумывать о женитьбе. Его избранницей стала дочь государственного канцлера Швеции Попиуса, старого друга Берцелиуса. Приготовления к свадьбе были долгими и торжественными. Предварительно Берцелиусу был пожалован титул барона. Наконец была сыграна пышная свадьба. В то время ему было пятьдесят шесть лет, а его жене, Иоанне, — двадцать четыре года. Разница в возрасте, однако, не помешала этому браку быть счастливым.
Деятельность Берцелиуса как ученого продолжалась до конца его дней. В частности, в 1836 году в журнале «Летописи по физике и химии» он опубликовал очень важную статью, в которой обращал особое внимание на весьма загадочное явление. Многие ученые наблюдали и изучали химические реакции, скорость которых значительно увеличивалась в присутствии другого вещества, по-видимому не принимавшего непосредственного участия в реакции. В своей статье Берцелиус привел несколько таких примеров. Вещество, изменяющее скорость реакции и остающееся неизменным после ее окончания, он назвал катализатором.
С особой тщательностью Берцелиус готовил теперь доклады для «Ежегодных обзоров». Это была одна из самых больших заслуг перед наукой в последние годы жизни ученого.
Йене Якоб Берцелиус — крупнейший ученый первой половины XIX века. Его заслуги в развитии химической науки огромны. Им проделана исполинская работа по определению атомных весов; ему принадлежит открытие и получение в чистом виде новых элементов — церия, селена, тория, кремния, титана, тантала, циркония и ванадия; его большая педагогическая деятельность дала мощный толчок развитию химии. Дело великого шведского химика было продолжено плеядой молодых ученых — его учеников, работавших в Швеции, России, Германии, Англии, Франции.
 Года жизни:
Года жизни: 


